
L’émergence assez médiatisée d’un nouveau courant « diététique », la « chrononutrition », suscite de plus en plus d’intérêt au sein du monde médical. Pour l’essentiel, elle indique que, selon le moment où on les avale, les aliments n’ont pas le même impact sur leur corps.
La « chrononutrition » emprunte beaucoup à une science authentique, plus ancienne qu’elle, qui se nomme la « chronobiologie ». Celle-ci a été initiée à la suite d’observations toutes simples ; les fonctions de notre corps ne se déroulent pas de manière constante au cours de la journée. Ces fluctuations sont parfois perçues de tous. Ainsi, la veille succède au sommeil au cours de la journée. Pour simple qu’elle paraisse, cette alternance est pourtant déterminée de manière assez complexe. Elle dépend à la fois d’une horloge interne, inhérente à chacun de nous, qui détermine un cycle immuable, et d’autres agents de synchronisation « externe».
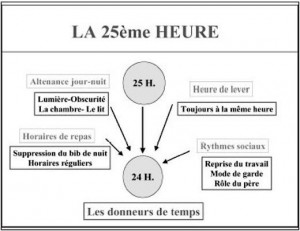 Ce sont ceux que les physiologistes nomment les « Zeitgeber » (donneurs de temps). Il va s’agir par exemple de l’alternance du jour et de la nuit. Les deux types d’influences, au final, conjuguent leurs effets pour aider l’homme à ajuster ses propres rythmes aux contraintes de l’environnement. Mais comme le notent la plupart des premières études sur la question, ces « ondulations » ne représentent que quelques pourcent de la valeur basale. Ainsi, Reilly (1) décrit une fluctuation de la force isométrique maximale, en fonction de l’heure de la journée, d’à peine 10% (515 à 550 N.m). Ces fluctuations endogènes sont, de l’avis de ces experts de la première heure « largement surpassés par les facteurs exogènes » (2).
Ce sont ceux que les physiologistes nomment les « Zeitgeber » (donneurs de temps). Il va s’agir par exemple de l’alternance du jour et de la nuit. Les deux types d’influences, au final, conjuguent leurs effets pour aider l’homme à ajuster ses propres rythmes aux contraintes de l’environnement. Mais comme le notent la plupart des premières études sur la question, ces « ondulations » ne représentent que quelques pourcent de la valeur basale. Ainsi, Reilly (1) décrit une fluctuation de la force isométrique maximale, en fonction de l’heure de la journée, d’à peine 10% (515 à 550 N.m). Ces fluctuations endogènes sont, de l’avis de ces experts de la première heure « largement surpassés par les facteurs exogènes » (2).
A titre de comparaison, l’impact de ces derniers a été évalué lors de situations telles que la pratique d’une activité physique. Dans ces travaux, il convient de dissocier l’effet chronobiologique propre, celui lié au manque de sommeil. Ces facteurs de pondération étant pris en compte, il apparaît alors que l’impact propre des rythmes endogènes sur les processus hormonaux et nerveux est nul, et complètement noyé sous les effets des secrétions hormonales et de l’activité nerveuse induits par le stress et par l’activité (3-4). Par exemple, sous l’effet d’un exercice de pédalage des bras effectué à une intensité croissante, le taux plasmatique de noradrénaline et l’activité locale du système nerveux sympatho-adrénergique (ΔMNSA), augmentent respectivement de 60 et 240% au niveau du palier d’effort le plus soutenu (5). Cette valeur est à rapprocher des ondulations liées aux rythmes « endogènes » qui n’excèdent pas 10 à 20%. Pour beaucoup d’autres paramètres (sécrétions hormonales, activités enzymatiques), il en va de même. Ainsi, comparativement au rythme endogène de la libération d’insuline, les pics enregistrés après une prise (matinale) de glucides, lors des premiers travaux sur l’index glycémique, sont d’un tout autre ordre de grandeur (6).
Or, ces études n’étaient pas réalisées au moment où la libération « spontanée » endogène d’insuline était supposée être maximale. Autrement dit, la quantité de glucides consommés et la nature des repas ingérés comptent beaucoup plus, relativement à l’insulino-secrétion, que le moment de la journée où cette prise se déroule.
Autre élément à considérer, un taux hormonal n’est pas équivalent à une action endocrine. Corréler les deux est largement spéculatif. Notons par exemple que la réponse hormonale intègre également des effets liés aux récepteurs et aux mécanismes post-récepteurs, difficiles à apprécier. Dans le domaine des neurosciences, par exemple, il existe des processus conduisant à une diminution (ou une augmentation) du nombre de récepteurs selon les circonstances (« up regulation » ou « down regulation »), ce qui a pour conséquence de maintenir un niveau constant l’information qui transite d’un neurone vers l’autre, de part et d’autre de la synapse, même lorsque le neurotransmetteur voit son taux chuter ou, au contraire croître de manière excessive.
Dans de telles situations, les fluctuations des taux de neurotransmetteurs ne sont plus représentatives de l’activité neuronale. Une telle plasticité des récepteurs est moins étudiée dans le domaine de l’endocrinologie, mais sa vraisemblable existence doit nous mettre en garde contre toute conclusion trop hâtive qui, corrélant des variations de paramètres hormonaux et des choix alimentaires particuliers (par exemple un apport glucidique à un instant « t » de la journée), inciterait à éliminer ou privilégier certaines denrées dans le seul but de « jouer » sur la réponse hormonale aux aliments considérés. Il convient donc de se méfier et de ne pas se lancer dans des extrapolations trop hasardeuses sur la seule base de tels paramètres biologiques. A l’appui de cette réflexion, considérons que quelques travaux menés dans le cadre de l’activité physique ont permis de pondérer, là aussi, l’importance des rythmes endogènes sur l’ampleur des processus physiologiques qui règlent notre métabolisme et notre nutrition.
Ainsi, l’utilisation des glucides apportés par l’alimentation, chez un sujet entraîné, n’a rien à voir avec celle qu’on constate chez un sujet sédentaire (7). En raison des adaptations survenant en réponse à l’entraînement, le muscle est placé en tête de la hiérarchie. Cela se traduit par deux effets :
- au repos le muscle capte davantage de glucose et, à apport équivalent, le convertit davantage en glycogène (8) que celui d’un individu sédentaire. Il s’agit d’une des adaptations chroniques induites par l’entraînement. Le tissu adipeux d’un sujet sportif est, pour sa part, moins apte à transformer le sucre en graisses, et ce 24 heures sur 24, ceci tant que le sujet garde un statut de sportif authentique, c’est-à-dire qu’il garde l’habitude de solliciter son tissu musculaire au moins trois fois par semaine durant trente mn.
 Juste après une séance, l’avidité du muscle est encore plus visible. Chez des sujets ayant épuisé leur glycogène et adoptant ensuite un régime hyper glucidique pendant 3 jours (comme avant un marathon), comprenant 10 g de glucides par kg de poids et par jour, seulement 3% de cet apport glucidique réalisé en 72 heures est converti en graisses (9). Et cela reste vrai quelle que soit l’heure à laquelle les pâtes, les tartes ou le pain ont été avalés. La mobilisation des Glu T4 sous l’effet de l’activité, et leur présence persistante plusieurs heures après le retour au calme figure parmi les mécanismes impliqués (10).
Juste après une séance, l’avidité du muscle est encore plus visible. Chez des sujets ayant épuisé leur glycogène et adoptant ensuite un régime hyper glucidique pendant 3 jours (comme avant un marathon), comprenant 10 g de glucides par kg de poids et par jour, seulement 3% de cet apport glucidique réalisé en 72 heures est converti en graisses (9). Et cela reste vrai quelle que soit l’heure à laquelle les pâtes, les tartes ou le pain ont été avalés. La mobilisation des Glu T4 sous l’effet de l’activité, et leur présence persistante plusieurs heures après le retour au calme figure parmi les mécanismes impliqués (10).- Cherchant à valider l’existence de moments plus propices à la combustion des lipides endogènes, des auteurs ont mesuré, à contenu identique, les fluctuations de la valeur de l’extra-chaleur enregistrée après un repas (6) proposé à différents moments de la journée aux mêmes volontaires (11). Il en ressort que ces sujets dépensent certes davantage d’énergie le matin, mais l’écart relevé entre les différents horaires étudiés, représente, au mieux, l’équivalent de 5% du total énergétique du repas, soit moins de 25 calories ! Comparativement, le métabolisme de repos est majoré de 20% plusieurs heures après l’arrêt d’un exercice modérément intensif, ce qui se traduit de manière beaucoup plus significative sur l’équilibre énergétique (12). Pour résumer, jouer sur d’éventuels créneaux horaires plus ou moins favorables pour influer sur la perte de poids semble très peu efficace.
 La « chrononutrition » suggère en outre que ces rythmes biologiques concernent aussi la synthèse de molécules impliquées dans le contrôle de fonctions importantes, telles que les prostaglandines d’où l’idée de réfléchir à une possible chronologie des apports leurs précurseurs ou modulateurs. Sur cette question, les éléments avérés, en 2009, sont finalement très peu nombreux à être validés, et à demeurer significatifs en dépit des facteurs extérieurs.
La « chrononutrition » suggère en outre que ces rythmes biologiques concernent aussi la synthèse de molécules impliquées dans le contrôle de fonctions importantes, telles que les prostaglandines d’où l’idée de réfléchir à une possible chronologie des apports leurs précurseurs ou modulateurs. Sur cette question, les éléments avérés, en 2009, sont finalement très peu nombreux à être validés, et à demeurer significatifs en dépit des facteurs extérieurs.
Voyons en détail, de manière non exhaustive, ceux qui sont le plus déterminants sur le plan fonctionnel :
- On sait que la synthèse des prostaglandines sous l’action de la phospholipase A2, est maximale le matin. Cette enzyme agit sur des acides gras polyinsaturés constitutifs des membranes qu’elle transforme de manière aléatoire en fonction de leurs proportions respectives. Le ration n-3/n-6 au sein des membranes serait donc un élément déterminant en ce qui concerne le contrôle de l’inflammation. Pour obtenir un effet anti-inflammatoire, certains auteurs proposent de consommer des acides gras précurseurs des eicosanoïdes anti-inflammatoires en début de journée (13). Cette proposition ne tient pas compte des réalités physiologiques. En effet, entre l’émulsion des acides gras, l’action des lipases, l’assimilation, l’incorporation aux lipoprotéines, l’intégration aux membranes tissulaires, et une éventuelle remise en circulation, il est impossible de prédire un délai moyen séparant l’ingestion de ces acides gras et leur positionnement dans la membrane, à proximité de l’enzyme. De ce fait, la modification du ratio « n-3/n-6 » au sein des membranes ne s’observe qu’à l’échelle de plusieurs semaines (14). Par conséquent, il paraît assez peu cohérent de proposer des acides gras polyinsaturés le matin plutôt qu’à un autre moment de la journée pour favoriser la prédominance de la synthèse des eicosanoïdes anti-inflammatoires (13). Pour résumer, cette recommandation n’est pas fondée sur le plan physiologique et aucune étude ne la valide, et à ce titre elle doit être abandonnée.
- On s’interroge également sur la possibilité de jouer sur la synthèse du cholestérol au moyen d’une stratégie alimentaire ciblée sur le plan chronologique. Rappelons que 85% de celui qu’on trouve dans le sang résulte d’une synthèse endogène, réalisée à partir de constituants simples de notre ration, sucres et graisses. Or, cette synthèse comprend plusieurs étapes, dont une est qualifiée de « réaction clef ». Cet enzyme est la HMG-CoA réductase (cible des médicaments appelés les « statines »), et elle peut faire l’objet d’une régulation par des apports alimentaires. Elle passe par un maximum d’activité en début de matinée.
- Ce qui a contribué à la mode consistant à conseiller de manger des œufs « seulement » le matin, pour inhiber l’enzyme en question. Or, toutes les études menées sur la question montrent une corrélation inverse entre l’apport alimentaire en cholestérol et son taux plasmatique. Mais cette relation inverse ne dépend pas du moment de la journée où cet apport est réalisé (15-7). Donc manger des œufs peut faire chuter le taux de cholestérol plasmatique, mais aucune contrainte horaire n’est déterminante dans cet effet.
Là aussi, le délai séparant la dégustation de l’œuf et l’effet inhibiteur du cholestérol qu’il contient sur la HMG-CoA réductase est imprévisible a priori. Souvenons-nous que le cholestérol, une fois assimilé, doit intégrer les lipoprotéines, circuler, être internalisé au niveau des récepteurs, et ensuite seulement gagner la cellule où il va réguler l’activité de l’enzyme. Il lui faut sûrement plus d’une heure pour accomplir ce trajet ! L’idée de donner spécifiquement les oeufs le matin pour abaisser la cholestérolémie totale n’est donc pas pertinente.
- On peut encore optimiser les apports des précurseurs des neurotransmetteurs en fonction des moments de la journée où les vitesses des voies de synthèse atteignent leurs valeurs maximales. Par exemple fournir des sources de tyrosine (acide aminé présent dans les produits d’origine animale) le matin, pour fabriquer la dopamine et la noradrénaline, puisque le pic de synthèse se situe en début de journée. Ou délivrer des compléments ou des aliments riches en tryptophane en fin d’après-midi, cet acide aminé permettant alors une synthèse plus efficace de la sérotonine.
Ceci est rendu possible par la rapide diffusion des acides aminés au niveau de la barrière hémato-méningée et par le fait que l’activité des enzymes-clefs des synthèses (tryptophane hydroxylase et tyrosine hydroxylase) est directement dépendante de la disponibilité des précurseurs.
C’est le seul facteur limitant, et le délai séparant la prise des précurseurs de la remontée des messagers est très court, et a fortiori reproductible. Les travaux de Robert Wurtman chez l’animal puis chez l’homme ont en effet montré que, chez un sujet déficitaire, on pouvait restaurer le niveau intracellulaire d’un neuromédiateur dans un délai très rapide. L’idée d’un apport chronologique des précurseurs nutritionnels de ces molécules reste donc valide, dans l’état actuel de nos connaissances. Chez un sujet exempt de déficits l’impact de ces précurseurs reste peu visible, les régulations enzymatiques (répression) ou concernant les récepteurs (up et down regulations) permettent de tamponner un apport excessif. Par contre, en cas de synthèse déficiente, l’apport accru et chronologiquement ciblé se montrera efficace. Cela indique que, si on s’en tient au seul problème du fonctionnement cérébral, tout le monde n’aura pas forcément besoin de manger une importante portion de protéines le matin. Cette recommandation profitera plutôt à ceux qui présentent des difficultés à fabriquer leur dopamine à un niveau correct
Au final, les éléments qui soutiennent un concept de « chrononutrition » sont très peu nombreux et ne justifient en tout cas aucunement l’engouement suscité par cette nouvelle approche de l’alimentation.

Denis Riché
Doctorat en nutrition humaine et
Spécialiste français de la micronutrition
BIBLIOGRAPHIE :
(1) : REILLY T (1990) : Human circadian rhythms. Biomed.Eng., 18 (3) : 165-180.
(2) : WINGET C, DE ROSHIA CW & Coll (1985) : Circadian rhythms and athletic performance. Med.Sci.Sports Exerc., 17 (5) : 498-516.
(3) : REINBERG A, PROUX S & Coll (1985) : Circadian rhythms in competitive sabre fencers : international desynchronisation and performance. Chronobiol.Intern., 2 : 195.
(4) : WINGET C, DE ROSHIA CW & Coll (1984) : A review of human physiological and performance changes associated with desynchronosis of biological rhythms. Aviat. Spac Env.Med., 55 : 1085-96.
(5) : SEALS DR, VICTOR RG & Coll (1988) : Plasma norepinephrine and muscle sympathetic discharge during rythmic exercise in humans. J.Appl.Physiol., 65 : 940-4
(6) : JENKINS DJA, WOLEVER TMS & Coll (1981) : Glycemic index of foods : A physiological basis for carbohydrate exchange. Am.J.Clin.Nutr., 34 : 662-6.
(7) : HOLLOSZY JO, BOOTH FW (1976) : Biochemical adaptations to endurance exercise in muscle. Ann.Rev.Physiol., 38 : 273-91.
(8) : HENRIKSSON J (1995) : Influence of exercise on insulin sensitivity. J Cardiovasc Risk.Aug; 2(4) : 303-9.
(9) : ACHESON K, SCHUTZ Y & Coll (1988) : Glycogen storage capacity and de novo lipogenesis during massive carbohydrate overfeeding in man. Am.J.Clin.Nutr., 48 : 240-7.
(10) : GOODYEAR LJ, HIRSCHMAN PM & Coll (1992) : Glucose transporter number, function and subcellular distribution in rat skeletal muscle after exercise training. Diabetes, 41 : 1091-9.
(11) : ROMON M, EDME JL & Coll (1993) : Circadian variation of diet-induced thermogenesis. Am.J.Clin.Nutr., 57 : 476-80.
(12) : RICHE D (1998) : “Guide nutritionnel des sports d’endurance”, Vigot Ed.
(13) : RAPIN JR (2007) : Arthrose et chronobiologie de la nutrition. NAFAS, 5 (1) : 39-42.
(14) : RYAN M, ZIMMERMAN B (1974) : Effect of prostaglandin precursors, DGLA and arachidonicacid on the vasoconstriction response to norepinephrine in the dog paw. Prostaglandins, 6 (3) : 179-92.
(15) : KUMMEROW FA, YOUNGJA K & Coll (1977) : The influence of egg consumption on the serum cholesterol level in human subjects. Am.J.Clin.Nutr., 30 : 664-73.
(16) : PORTER MW, YAMANAKA W & Coll (1977) : Effect of dietary egg on serum cholesterol and triglyceride of human males. Am.J.Clin.Nutr., 30 : 490-5.
(17) : QUINTAO E, GRUNDY SM & Coll (1971) : Effects of dietary cholesterol oh the regulation of total body cholesterol in man. J.Lipid Res., 12 : 233-42.

SDPO-mag 16 rue Jean Cocteau 95350 Saint Brice sous Forêt Tél : 01 39 94 01 87
Site Internet : www.sdpo.com Email : sdpo@sdpo.com


